Atomphysik
Atommodelle
Das Bohr'sche Atommodell
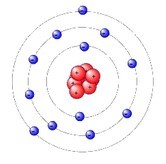
Die Grundlage dieses kurzen Beitrags ist das Bohrsche Atommodell (Niels Bohr, dänischer Physiker, 1885 - 1962). Ein Atom besteht aus dem Atomkern und einer Elektronenhülle; im Atomkern sind Protonen und Neutronen. Die Anzahl der Protonen bestimmt, welches Element man gerade vor sich hat. Protonen haben eine positive elektronische Ladung, Elektronen eine gleichgroße negative. Gegensätzliche Ladungen ziehen sich erfahrungsgemäß an. Diese elektronische Kraft hält die Elektronen auf einer Bahn um den Atomkern.
Bohr nahm an, dass die Elektronen sich nur auf bestimmten, festen Bahnen bewegen können. Das erklärt, warum zwei Elektronen auf einer "inneren Bahn" fliegen und acht weiter außen usw. Es ist auch möglich, unter Energieabgabe auf eine weiter innen befindliche Bahn zu springen. Umgekehrt geschieht ein Wechsel nach "außen" durch Energieaufnahme.
Die Atome sind bestrebt, ihre Elektronenschalen aufzufüllen. So können auch Atome mit ganz anderen Atomen Verbindungen eingehen. Zum Beispiel hat das Atom Natrium (Na) auf seiner äußersten Schale ein Elektron. Dem Chloratom (Cl) fehlt außen ein Elektron. Die Verbindung zwischen beiden entsteht, indem ein Natriumatom sein überzähliges Elektron an das Chloratom abgibt. Das Ergebnis ist eine stabile Verbindung zu Kochsalz (NaCl).
Footer
Der Besucher-Zähler zählt die Seitenaufrufe.
Einige Linktipps
Diese Webseite wurde mit Jimdo erstellt! Jetzt kostenlos registrieren auf https://de.jimdo.com